Όταν δημοσιεύθηκε το πρώτο προσχέδιο του ανθρώπινου γονιδιώματος1,2, αναμενόταν να έχει μετασχηματιστικό αντίκτυπο στην ιατρική. Έντονες προβλέψεις έγιναν για μια αλλαγή παραδείγματος στην οποία το φάρμακο έγινε εξατομικευμένο, προγνωστικό και προληπτικό3. Για πολλούς, δεν πραγματοποιήθηκε τέτοιος μετασχηματισμός, πιθανώς λόγω εστίασης σε κοινές ασθένειες όπως ο διαβήτης και η στεφανιαία νόσος. Όμως, οι προβλέψεις ήταν σωστές στο στόχο για τις ασθένειες της Μεντελιάς – αυτές που προκαλούνται από μεταλλάξεις στα μεμονωμένα γονίδια – όπως οι κληρονομικοί καρκίνοι και πολλές μορφές αναπτυξιακής καθυστέρησης στα παιδιά.
Πριν από το σχέδιο γονιδιώματος, βασικές πληροφορίες σχετικά με την αλληλουχία και τη γονιδιωματική θέση ενός μεταλλαγμένου γονιδίου έπρεπε να επεξεργαστούν μέσω μιας διαδικασίας που ονομάζεται κλωνοποίηση, στην οποία σύντομα χρωμοσωμικά τμήματα κόπηκαν από ανθρώπινο DNA χρησιμοποιώντας ένζυμα και αναπαράχθηκαν σε βακτήρια για να παράγουν επαρκείς ποσότητες για ανάλυση. Η κλωνοποίηση ήταν μια επίπονα επίπονη άσκηση που χρειάστηκε συχνά χρόνια και μπορούσε να πραγματοποιηθεί μόνο από λίγα εργαστήρια. Οι γενετικές βάσεις των περισσοτέρων Μεντελικών ασθενειών ήταν άγνωστες, καθιστώντας τη διάγνωση εξαιρετικά δύσκολη. Ακόμα και για τους λίγους που είχαν γνωστή υποκείμενη γενετική βάση (όπως το εύθραυστο σύνδρομο Χ), ένας ειδικός ήταν πιθανό να αποτύχει να κάνει διάγνωση, λόγω της αξιοσημείωτης μεταβλητότητας της κλινικής παρουσίασης των ασθενειών και της σπανιότητάς τους4.
Στη δεκαετία του 1990, η ανάπτυξη μεθόδων «χαρτογράφησης θέσης» διευκόλυνε τον εντοπισμό γονιδίων που σχετίζονται με ασθένειες της Μεντελίας. Οι πρώτες προσπάθειες χαρτογράφησης θέσης περιελάμβαναν τη σύγκριση του DNA πολλών ανθρώπων που είχαν την ίδια ασθένεια, χρησιμοποιώντας έναν πρωτόγονο χάρτη γονιδιώματος που περιέχει μερικές γνωστές αλληλουχίες που ποικίλλουν μεταξύ των ατόμων. Αυτά λειτουργούσαν ως δείκτες θέσης για να βοηθήσουν τους ερευνητές να μηδενίσουν μια υποψήφια περιοχή που προκαλεί ασθένειες5. Ο πρωτόγονος χάρτης, που χρονολογείται από το 1987, ήταν απαραίτητος για τις πρώιμες προσπάθειες ανακάλυψης γονιδίων. Ωστόσο, η χαμηλή ανάλυσή του ήταν ένα σημαντικό εμπόδιο στις προσπάθειες ανακάλυψης γονιδίων.
Είναι λοιπόν δύσκολο να υπερεκτιμήσουμε πόσο επιρροή ήταν το προσχέδιο του ανθρώπινου γονιδιώματος για τα άτομα με Μεντελιανές ασθένειες και τις οικογένειές τους. Το προσχέδιο δεν συνέδεσε άμεσα μεμονωμένα γονίδια με ασθένειες, αλλά παρείχε τα απαραίτητα στοιχεία για μια επανάσταση στη διάγνωση. Αρχικά, παρείχε έναν πλούσιο χάρτη δεικτών που επέτρεπε μια πολύ υψηλότερη ανάλυση στη χαρτογράφηση θέσης. Ωστόσο, η πραγματική αλλαγή παιχνιδιού ήρθε όταν το πρόχειρο γονιδίωμα χρησιμοποιήθηκε σε συνδυασμό με τεχνολογίες αλληλουχίας «επόμενης γενιάς», οι οποίες διαβάζουν ολόκληρα γονιδιώματα και όχι μεμονωμένα γονίδια4. Αυτό έδωσε στους ερευνητές τη δυνατότητα να εντοπίσουν πιθανές παραλλαγές που προκαλούν ασθένειες στο γονιδίωμα πολύ πιο γρήγορα από ό, τι στο παρελθόν ήταν δυνατό.
Χάρη σε αυτήν την τεχνολογική πρόοδο, ο αριθμός των ασθενειών της Μεντελικής που έχουν γνωστή γενετική αιτία αυξήθηκε από 1.257 το 2001 σε 4.377 κατά τη στιγμή της γραφής (σύμφωνα με τη βάση δεδομένων OMIM, έναν ηλεκτρονικό κατάλογο ανθρώπινων γονιδίων και διαταραχών. Go.nature.com / omimdb). Οι ασθενείς απελευθερώνονται όλο και περισσότερο από τη μακροχρόνια διαγνωστική συμφόρηση. Πολλοί μπορούν να λάβουν μια διάγνωση σε ώρες όταν απαιτείται επειγόντως, με ακρίβεια που παραμένει απαράμιλλη στην ιατρική. Αυτό άνοιξε την πόρτα για μια πραγματική εξατομίκευση της διαχείρισης των ασθενειών. Για παράδειγμα, υπάρχουν διαθέσιμες θεραπείες για ορισμένες γενετικές παραλλαγές που προκαλούν ασθένειες, όπως αυτές στο γονίδιο CFTR που προκαλούν κυστική ίνωση. Μπορούμε επίσης να αποφύγουμε μάταιες παρεμβάσεις, όπως η θεραπεία με αυξητική ορμόνη που θα ήταν αναποτελεσματική σε παιδιά που έχουν Μεντελιανή πάθηση που ονομάζεται σύνδρομο Seckel, ένα είδος νάνου.
Μόλις δημιουργηθεί μια συσχέτιση μεταξύ μιας νόσου της Μεντελίας και ενός γονιδίου, η ασθένεια είναι πολύ προβλέψιμη, πράγμα που σημαίνει ότι είναι δυνατή η πρόληψη. Για παράδειγμα, το Αμερικανικό Κολλέγιο Ιατρικής Γενετικής και Γονιδιωματικής συνιστά στα άτομα που έχουν τα γονιδιώματά τους να αλληλουχούν για οποιονδήποτε διαγνωστικό σκοπό να ενημερώνονται εάν φέρουν παραλλαγές που προκαλούν ασθένειες σε οποιοδήποτε από τα 59 γονίδια6 που συνδέονται με δυνητικά απειλητικές για τη ζωή συνθήκες της Μεντελιάς για τις οποίες υπάρχει προληπτική διαχείριση. Μια πρόσφατη μελέτη αλληλούχησης7 στο Ηνωμένο Βασίλειο, με τη συμμετοχή περίπου 50.000 εθελοντών ηλικίας μεταξύ 40 και 69 ετών, έδειξε ότι το 2% διαθέτει τέτοιες παραλλαγές με δυνατότητα δράσης. Και πρώιμα δεδομένα8 δείχνουν ότι ο έλεγχος βάσει πληθυσμού για αυτές τις παραλλαγές οδηγεί σε υψηλό ποσοστό υιοθέτησης διαδικασιών διαχείρισης κινδύνου. Η ικανότητα ανίχνευσης αυτών των παραλλαγών και πολλών άλλων που θα ακολουθήσουν – καθώς και παραλλαγών που επηρεάζουν τις αποκρίσεις στα ναρκωτικά – προσφέρει μια ματιά στα πιθανά ιατρικά οφέλη ενός μέλλοντος στο οποίο η αλληλουχία του γονιδιώματος είναι καθολική.
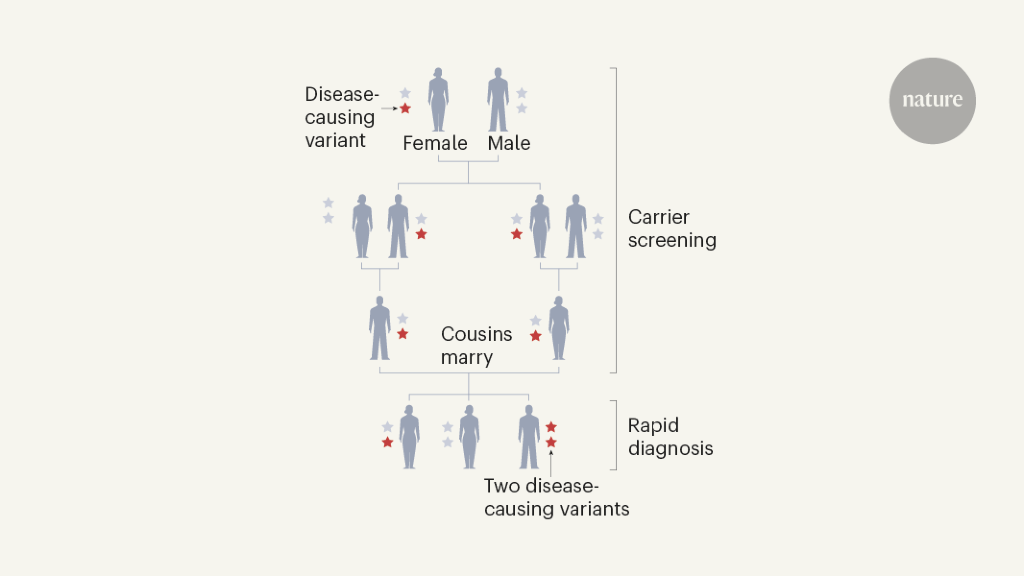
Ένα άλλο πλεονέκτημα της αλληλουχίας γονιδιώματος μεγάλης κλίμακας είναι η αναπαραγωγική ενδυνάμωση. Ο έλεγχος φορέα καθορίζει εάν ένα άτομο φέρει ένα αντίγραφο μιας «υπολειπόμενης» γενετικής παραλλαγής, το οποίο θα προκαλούσε ασθένεια εάν υπάρχει και στα δύο αντίγραφα του εν λόγω γονιδίου – συνήθως όταν και οι δύο γονείς μεταφέρουν και μεταβιβάζουν την παραλλαγή σε ένα παιδί (Εικ. 1) . Με τη γνώση αυτή, οι μεταφορείς μπορούν να κάνουν ενημερωμένες αναπαραγωγικές επιλογές. Η ασθένεια Tay – Sachs και η θαλασσαιμία, δύο απειλητικές για τη ζωή καταστάσεις που προκαλούνται από υπολειπόμενες παραλλαγές, έχουν εξαλειφθεί σε μεγάλο βαθμό σε κοινότητες υψηλού κινδύνου στη Νέα Υόρκη και την Κύπρο, αντίστοιχα, με διαλογή φορέων9. Ένα μέλλον στο οποίο αυτό το μοντέλο επεκτείνεται για να στοχεύσει όλα τα σοβαρά ή θανατηφόρα γονίδια της Μεντελικής νόσου είναι εφικτό, και υποστηρίζεται από τον ιδιωτικό τομέα και από δημόσιες χρηματοδοτούμενες πρωτοβουλίες. Ωστόσο, είναι σημαντικό να σημειωθεί ότι υπάρχει πολύ ηθική συζήτηση σχετικά με τη χρήση γενετικού ελέγχου για αναπαραγωγικές επιλογές, με ανησυχίες σχετικά με τον «έλεγχο» ορισμένων ομάδων, καθώς και άλλους κοινωνικούς κινδύνους. Επιπλέον, η χρήση γενετικού ελέγχου για χαρακτηριστικά που δεν σχετίζονται με την υγεία δεν θεωρείται ηθική.
Πουθενά δεν θα έχει ο έλεγχος των φορέων μεγαλύτερη επίδραση από ό, τι σε χώρες όπου τα συνδικάτα μεταξύ ξαδέλφων είναι κοινά. Επειδή τα ξαδέρφια μοιράζονται περισσότερες παραλλαγές από ό, τι τα μη συγγενή άτομα, είναι πιο πιθανό να μοιράζονται και να μεταδίδουν επιβλαβείς υπολειπόμενες παραλλαγές, προκαλώντας υπολειπόμενες ασθένειες. Η Σαουδική Αραβία είναι μια συγκεκριμένη περίπτωση. Όταν δημοσιεύτηκε το αρχικό προσχέδιο του ανθρώπινου γονιδιώματος, η Σαουδική Αραβία είχε τα υψηλότερα τεκμηριωμένα ποσοστά υπολειπόμενων ασθενειών στον κόσμο10. Είκοσι χρόνια αργότερα, σχεδόν όλες οι μεγάλες υπολειπόμενες ασθένειες στη χώρα έχουν χαρακτηριστεί σε επίπεδο γονιδίου11. Αμέτρητα ζευγάρια έχουν επιδιώξει αναπαραγωγικές επιλογές που ενημερώνονται με παραλλαγή ταυτοποίησης και η χώρα βρίσκεται στο κατώφλι της ανάπτυξης ενός εκτεταμένου προγράμματος προβολής.
Η βελτιωμένη κατανόησή μας για τις ασθένειες της Μεντελίας έχει επίσης αρχίσει να ωφελεί τα άτομα με κοινές ασθένειες που έχουν πολύπλοκες γενετικές βάσεις. Για παράδειγμα, μια μελέτη αλληλουχίας 20207 αποκάλυψε ότι, για ένα μικρό αλλά σημαντικό μέρος των ανθρώπων που έχουν κοινές ασθένειες, είναι η αιτία μιας και μόνο γενετικής παραλλαγής – δηλαδή, έχουν μια μορφή Μεντελικής νόσου. Εκτός από την αιτιώδη συνάφεια, τα γονίδια που σχετίζονται με διαταραχές της Μεντελίας έχουν βρεθεί ότι είναι παράγοντες κινδύνου για πολλές κοινές ασθένειες12. Οι νέες θεραπείες για κοινές ασθένειες ενημερώνονται καθαρά από την ανθρώπινη γονιδιωματική και τα γονίδια της Μεντελιάς δεν παίζουν κανένα μικρό ρόλο σε αυτό13.
Η κοινότητα της ιατρικής γενετικής έχει συχνά κατηγορηθεί για υποσχέσεις14. Όμως, η γονιδιωματική βελτιώνει πραγματικά την υγεία των ανθρώπων. Αυτό δεν είναι μόνο μια δικαίωση αλλά και μια έμπνευση για να συνεχίσουμε να ξαναγράφουμε φάρμακα χρησιμοποιώντας το DNA μας.